有機化学

 アルカン
アルカン
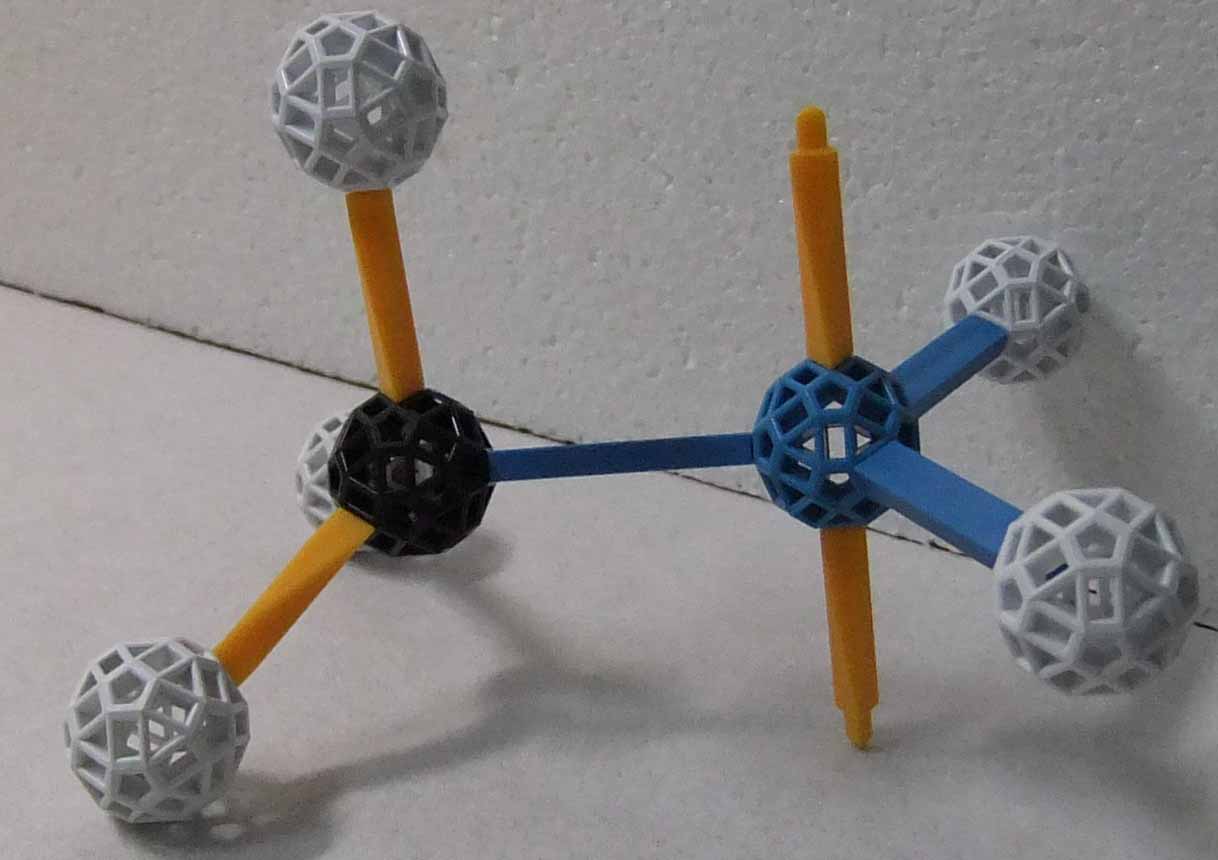
鎖状飽和炭化水素(環状構造を持たず、全ての炭素-炭素結合が単結合である炭化水素)をアルカンという。アルカンの一般式は CnH2n+2 で示される。最も簡単なアルカンは n=1 のメタン CH4 であり。メタンでは全てのC-H結合は等価であるので、メタン分子は炭素を中心にした正四面体分子である。n=2 のアルカンがエタンであり、エタン C2H6 はメチル基(-CH3、メタンからH原子が1つ外れてできるグループ)が2つ結びついてできた分子である。エタンではC-C軸の回りにメチル基は回転でき、無数の配座異性体が可能であるが、その中で最も安定であるのは、次に示したように、H原子どうしが最も離れた位置になっているものである。以下に示したzomeによる分子模型では、黒ノードが炭素原子、白ノードが水素原子を表している。
C3H8 はプロパンであり、メタンからプロパンまでには異性体(同一分子式で示されて物性が異なるもの)は存在しない。しかし、分子式が C4H10 のアルカンには、直鎖状のブタン CH3CH2CH2CH3 と、側鎖を持つ 2-メチルプロパン CH3CH(CH3)CH3 の2種類の異性体が存在する。
 アルケン
アルケン
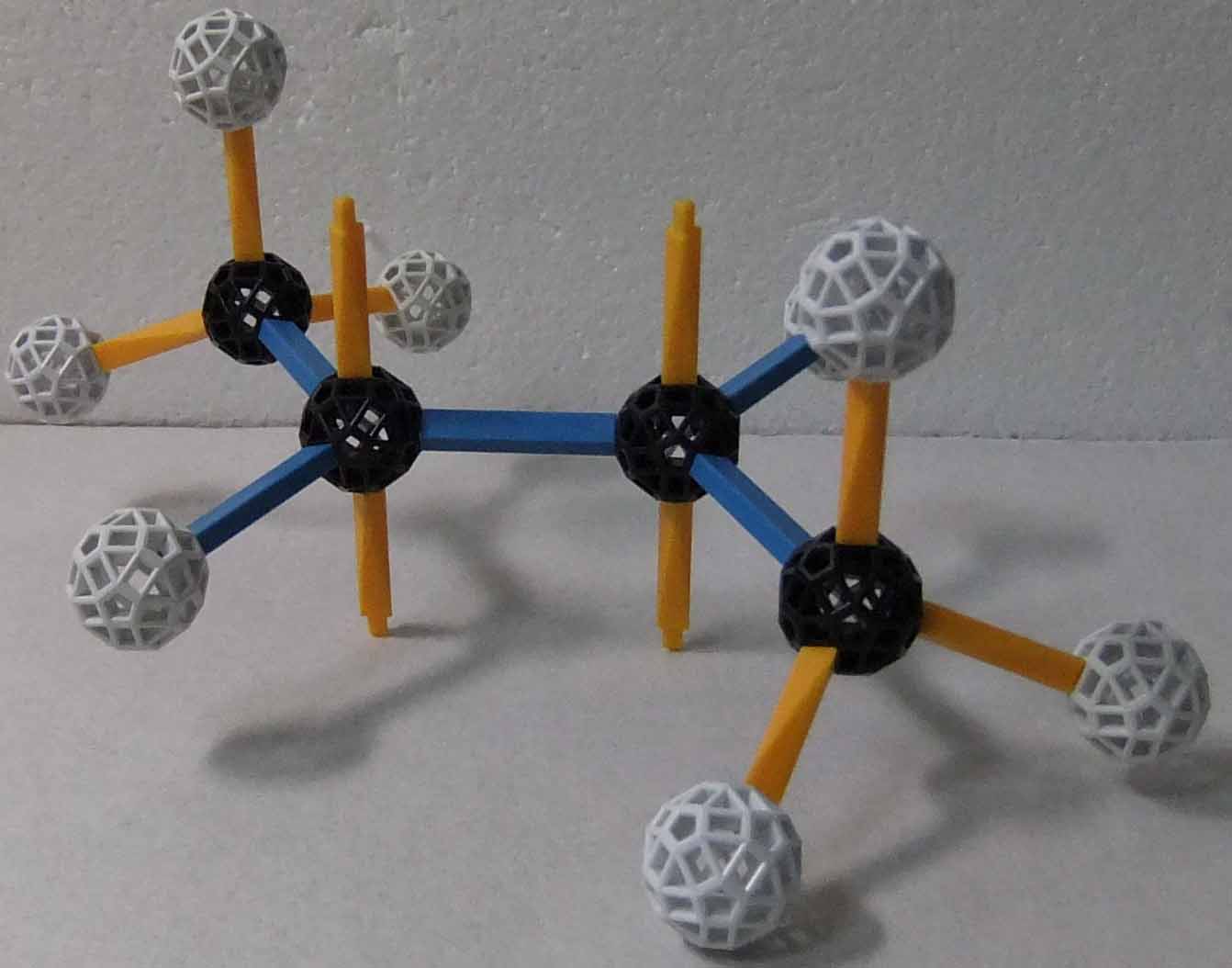
鎖状不飽和炭化水素でC=C二重結合を1つ持つものをアルケンという。アルカンの一般式は CnH2n で示される。最も簡単なアルケンは分子式が C2H4 であるエチレン(組織名はエテン)である。C=C二重結合は、C-C単結合と同種のσ結合(結合の方向と軌道の重なりが一致する結合)と、π結合(結合の方向と軌道の重なりが直交する結合)の2つからできている。次のzomeによる分子模型では、π結合は 2つのp軌道(黄色のストラットがそれを示すとした)によるとした。今度は、単結合(正確にはsp2orbitalが関与する結合)は全て青色ストラットで表現されている。分子模型でも分かるように、3つのσ結合(青色ストラット)は同一平面上に位置し、互いにほぼ120°を為す方向を向いている。従って、エタン分子では全ての原子は同一平面上に位置している。π結合はσ結合が作る平面と直交する方向にあるp軌道(黄色ストラット)どうしが重なることでできる結合である(黄色ストラットに黄色のゴム帽などを被せて、p軌道らしくした方が良いかも知れない)。
炭素数=4のアルケンには、構造異性体(分子式は同じであるが構造式が異なる異性体)として、1-ブテン、2-ブテン、メチルプロペンの3種類が存在する。この中で、2-ブテン CH3CH=CHCH3には、C=C二重結合軸の回りで、この炭素に結合する原子(or基)が、室温で回転が制限されるので、二重結合の同じ側にメチル基がくるもの(cis体)と反対側にメチル基がくるもの(trans体)は別なものになる。次に示した zome の模型で分かるように、二重結合の内のπ結合は、2つの炭素原子のp軌道(ノードが付いていない黄色ストラットで示している)からなるので、二重結合の一方の炭素原子が回転すれば、π結合は切れてしまうので、cis体とtrans体は別な物になるのである。一般に原子(or基)の空間的な位置が固定されてしまうことで生じる異性体を立体異性体という。cis体とtrans体の異性をシス-トランス異性(幾何異性)といい、二重結合や環でできる。
 |  |  |
| エチレン(エテン) | cis-2-ブテン | trans-2-ブテン |
 アルキン
アルキン
鎖状不飽和炭化水素でC≡C三重結合を1つ持つものをアルキンという。アルキンの一般式は CnH2n-2 で示される。最も簡単なアルキンは分子式が C2H2 であるアセチレン(組織名はエチン)である。アセチレン H-C≡C-H 直線分子であり、2つの炭素原子どうしの三重結合はσ結合とこれに直交する2つのπ結合からできている。zomeでは、σ結合を青ストラットで示し、これに直交する2つのp軌道もノードの付いていない青ストラットを用いることで(青ストラットに別の色のゴム帽などを被せて、p軌道らしくした方が良いかも知れない)、三重結合も表すことが可能である。
 |
| アセチレン |
 シクロアルカン
シクロアルカン
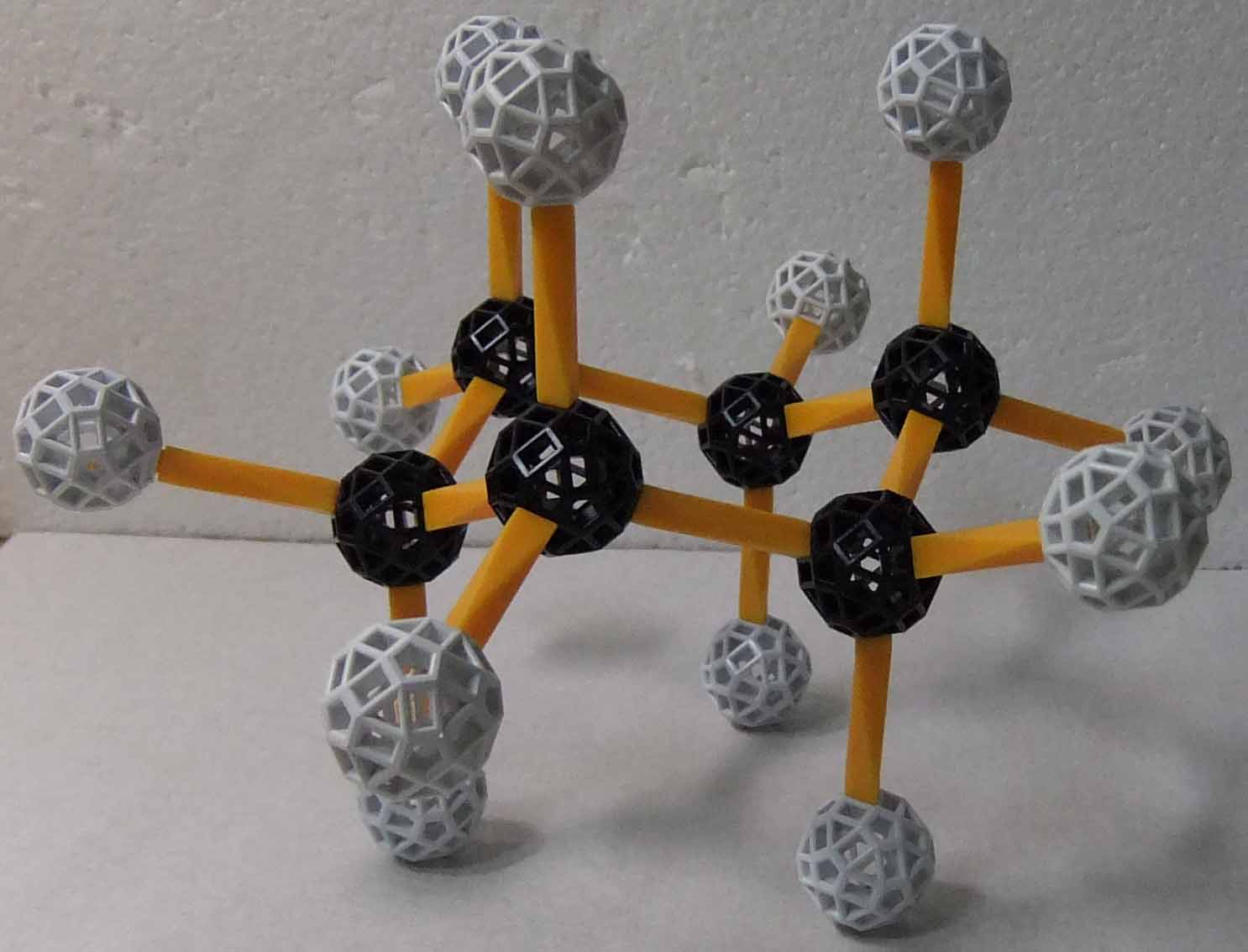
環状飽和炭化水素で環を1つ持つものをシクロアルカンという。シクロアルカンの一般式は CnH2n で示される。従って、シクロアルカンとアルケンは構造異性の関係にある。最も小さなシクロアルカンは、3員環であるシクロプロパン C3H6 であり、3つの炭素原子は同一平面上に位置し、結合角∠CCCは60°になるので、C-C単結合の結合角の正四面体角から大分ずれており、それだけ歪みが大きく、実際にシクロプロパンは爆発し易い気体である。青ストラットを用いて zome でシクロプロパンを作ったが、1つの炭素原子に結合する2つの水素原子が環の上下の方向を向くというところまでは良いのであるが、環の上下での結合の角度が等しくならないのが残念である。
4員環のシクロブタン、5員環のシクロペンタンになるにつれて、この手の歪みは次第に小さくなり、6員環であるシクロヘキサンでは結合角∠CCCは正四面体角になるので、歪みは殆どなくなる。シクロヘキサンのC-C結合は単結合なので回転可能となり、これにより無数の配座異性体が存在し得るが、その中で最も安定なものは次のzome模型で示される椅子型構造のシクロヘキサンである。zomeによる模型で分かるのであるが、椅子型構造のシクロヘキサンでは、どのC-C結合軸から見ても、水素原子どうしは最も離れた位置になっている。
 |  |
| シクロプロパン | シクロヘキサン(椅子型) |
 共役ジエン
共役ジエン
鎖状不飽和炭化水素でC=C二重結合を2つ持つものをアルカジエンという。アルカジエンの一般式は CnH2n-2 で示され、アルカジエンとアルキン、シクロアルケンは共に構造異性の関係にある。アルカジエン(ジエン)の中で、C=C-C=C と二重結合と単結合が繰り返される構造のものを共役ジエンという。最も簡単な共役ジエンは 1,3-ブタジエン(but-1,3-diene) CH2=CH-CH=CH2 である。 zomeでは、1,3-ブタジエンのσ結合は青ストラットでπ結合するp電子はノードなしの黄ストラットで構築される。この分子模型を見ると、構造式 CH2=CH-CH=CH2 が示すように π結合は1位と2位の炭素原子間及び3位と4位の炭素原子間に局在化しているのではなく、1位から4位までの炭素原子に非局在化していることが分かる。2位の炭素と3位の炭素間の結合は構造式では単結合であるが、二重結合性を帯びた結合になることが理解できる。ということで、二重結合間では炭素原子に結合する原子(or基)の回転が制限されるので、1,3-ブタジエンにはcis体とtrans体が可能となる。
 |  |
| s-trans-1,3-ブタジエン | s-cis-1,3-ブタジエン |
因みに、1,3-ブタジエンの2位のH原子の代わりにメチル基 CH3 が付いたものがイソプレンであり、天然ゴムは、イソプレンが cis で付加重合してできたものである。
 芳香族炭化水素
芳香族炭化水素
ベンゼン C6H6 分子の持つベンゼン環という特殊な環状構造を持つ化合物(及びこれに類似した構造を持つ化合物)を芳香族化合物という。芳香族化合物で炭化水素を芳香族炭化水素といい、ベンゼンが最も簡単な芳香族炭化水素ということになる。ベンゼン自体はファラデーにより発見され、ベンゼンはその不飽和度からは考えられない位化学的に安定な物質であったので、どういう構造を持った分子なのかは長らく謎であったのであるが、その構造式はケクレによりケクレの式という形で示されるものとして提唱され、今日でも、このケクレの式は用いられている。
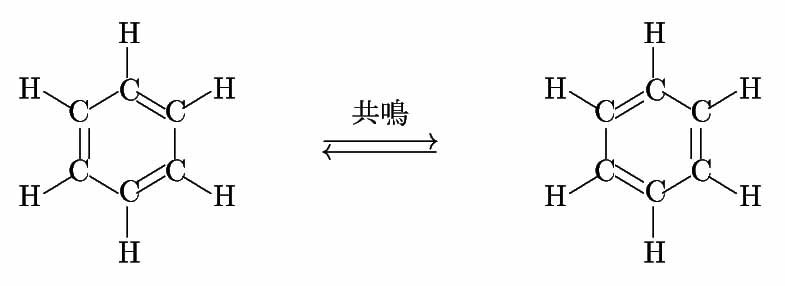
ケクレの式
尚、ベンゼン環は、様々な有機化合物中に登場するので、ケクレの式は、通常は次のような省略した構造式で示される。
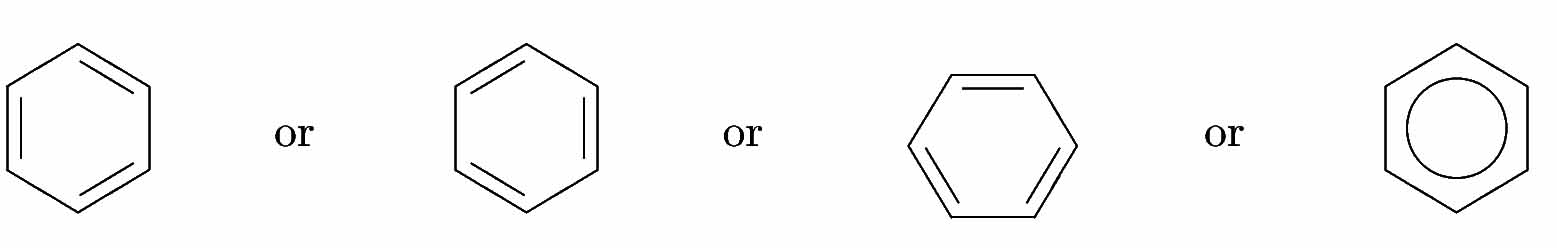
ベンゼン環の構造式の省略形
ベンゼン分子はzomeによりかなり正確に作ることができる。ベンゼン分子内の全てのσ結合は青ストラットで作ることができる。これにより、実際のベンゼン分子と同様に分子模型でも全ての原子は同一平面上に位置する。そして、各炭素原子上にはp軌道(ノードが付いていない黄色ストラットで示される)が全体で重なったπ結合を形成する。つまり、各炭素原子上のp軌道にある電子1個ずつ合計6つの電子がベンゼン環の上下に広がるπ軌道に非局在化して存在することになるので、ベンゼンは化学的に安定になる。この為、ベンゼンを構造式で示す場合は、上記の「ベンゼン環の構造式の省略形」で示した一番右側の構造式がベンゼンの結合を最も良く表しているということになり、最近では高校化学の教科書もこの構造式も採用している。
 |
| ベンゼン |
 アルコールとエーテル
アルコールとエーテル
炭化水素基(-R)にヒドロキシ基(-OH)が付いた化合物 R-OH をアルコールという。最も簡単なアルコールはメタノール(メチルアルコールというのは慣用名) CH3OH である。メタノール分子模型をzomeで作ると次の通りとなる。赤ノードが酸素原子であり、この模型では酸素原子上にある非共有電子対2組は省略されている。酸素原子上に非共有電子対があるので、C-O-H 結合は一直線にはならない。
メタノールに次いで簡単なアルコールはエタノール(エチルアルコールというのは慣用名) C2H5OH である。エタノールの分子式は C2H6O であり、これと同じ分子式で示される物質としてジメチルエーテル CH3OCH3 がある。エタノールとジメチルエーテルのように、同一の分子式で示されるけれども別々の物質になるものを異性体という。尚、異性体にはエタノールとジメチルエーテルの関係のように、原子の繋がり方が異なる構造異性体と原子の繋がり方は一緒であるが原子或いは基の空間的な位置が固定されることで生じる立体異性体がある。立体異性の一つがシス・トランス異性であり、他に光学異性もある。
次の左図はzomeで作ったエタノール分子で右図はジメチルエーテルである。共に、酸素原子上にある非共有電子対は省略されている。
 |  |
| エタノール | ジメチルエーテル |
 カルボン酸
カルボン酸
分子中にカルボキシ基(-COOH)を持つものをカルボン酸といい、カルボン酸は弱酸性を示す。最も簡単なカルボン酸はギ酸(メタン酸) HCOOH である。次に簡単なカルボン酸は酢酸(エタン酸) CH3COOH である。カルボキシ基の炭素には2つの酸素原子が結合しているが、一方は C-O-H と単結合をしており、他方は C=O と二重結合をしている。次の図で左が酢酸である。カルボキシ基の炭素原子は sp2 混成状態にあり、3つのsp2は炭素原子及び2つの酸素原子の軌道とσ結合を形成し、価電子の内で残り1個は 2p 軌道に存在する(2p軌道は上下の黄ストラット1組で示されている)。炭素原子の 2p軌道と酸素原子の2p軌道どうしが結合に直交するする形で重なりπ結合が形成される。
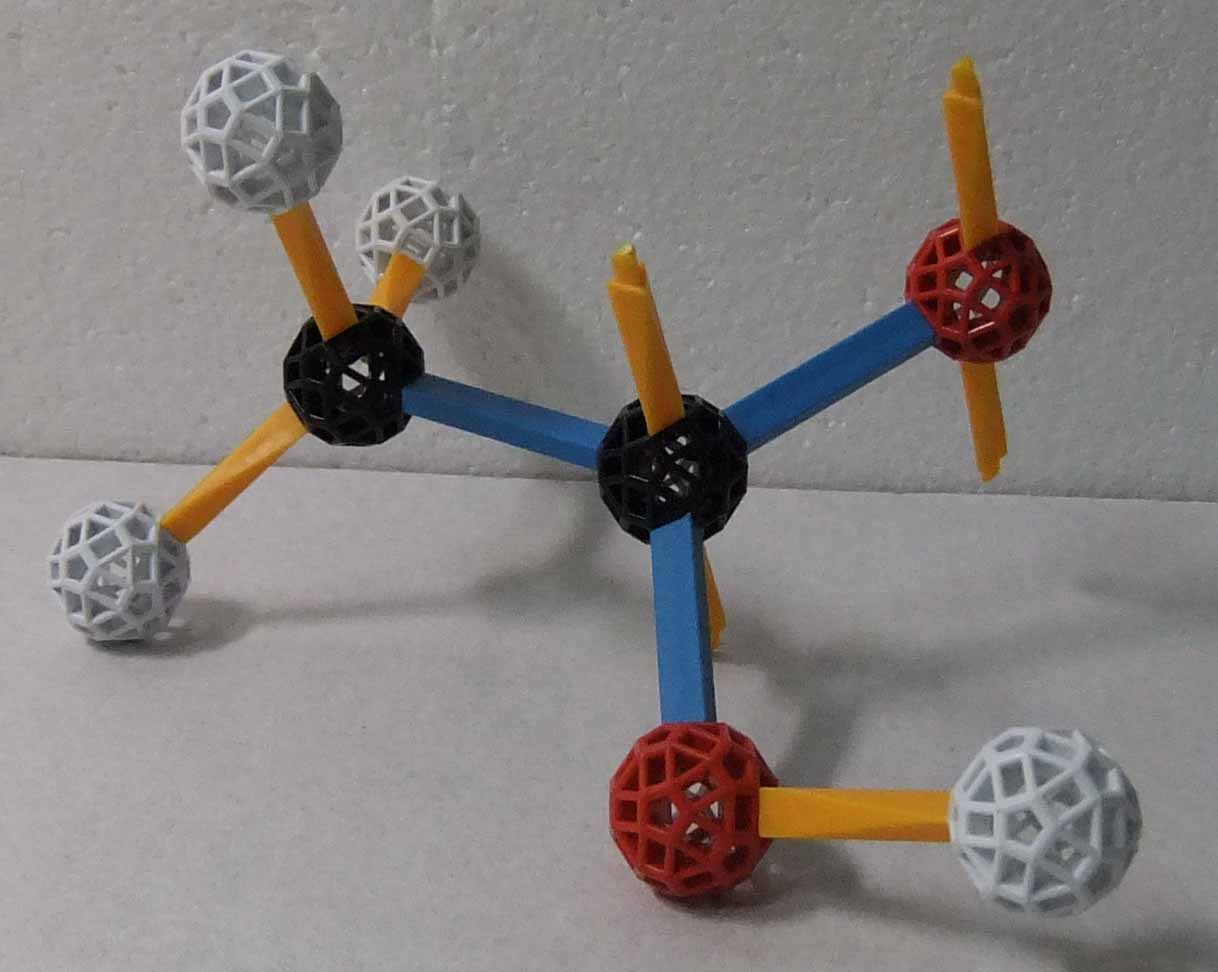 |  |
| 酢酸 | 酢酸イオン |
酢酸分子がプロトン(H+)を失ってできるのが、酢酸イオン CH3COO- である。上の右図がzomeで作った酢酸イオンの模型である。酢酸イオンになると、2つの酸素原子は共に炭素原子とσ結合とπ結合ができるようになるが、2つのπ結合の間で電荷の非局在化が起こるので、多少安定になる。これが酢酸がプロトン(H+)を放す、つまり、酸として働くことができる理由である。
 アルデヒドとケトン
アルデヒドとケトン
カルボニル基 >C=O にH原子がついたものをアルデヒド基といい、アルデヒド基は示性式では -CHO と記す。カルボニル基に両方ともC原子が付いたものがケトンである(こちらのカルボニル基をケトン基という場合がある)。尚、カルボキシ基はカルボニル基にヒドロキシ基(-OH)が付いたものということになる。
最も簡単なアルデヒドはホルムアルデヒド(メタナール) HCHO であり、次に簡単なものがアセトアルデヒド(エタナール) CH3CHO である。アセトアルデヒド分子をzomeで作ったものが次の図のものである。アルデヒド基の炭素原子は sp2 混成状態にあり、3つのsp2軌道(青ストラットで示されている)にそれぞれ1個の電子が入っていて、この3つのsp2軌道が作る平面に直交する2p軌道(上下2つの黄ストラット1組で示される)に電子が1個はいっている。そして、アルデヒド基の炭素原子の1つのsp2軌道とメチル基の炭素原子の2p軌道とσ結合(黒ノード間の青ストラットがそれである)を作り、もう1つのsp2軌道と水素原子の1s軌道でσ結合を形成し、残りの1つのsp2軌道と酸素原子の2p軌道でσ結合を形成する。そして、アルデヒド基の炭素原子の2p軌道(黄ストラット)と酸素原子の2p軌道(黄ストラット)でπ結合を形成するのである。残念乍らこのπ結合はzomeでは直接示すことはできないので、頭の中に思い描いて欲しい。
最も簡単なケトンはアセトン(プロパノン) CH3COCH3 or (CH3)2CO であり、カルボニル基にメチル基(-CH3)が2つついたものである。次のものがzomeで作ったアセトン分子である。カルボニル基の炭素原子はsp2 混成状態にあり、酸素原子とσ結合(青ストラット)とパイ結合(上下2個で1組の黄色ストラット2組でできる)からなる。
尚、アセトン CH3COCH3 と、プロピルアルデヒド(プロパナール) CH3CH2CHO とは構造異性の関係にある。一般にアルデヒドとケトンは互いに構造異性体である。
 (カルボン酸)エステル
(カルボン酸)エステル
カルボン酸 RCOOH と、アルコール R'OH との脱水縮合生成物を(カルボン酸)エステルといい、示性式は RCOOR' で示される。最も簡単なエステルはギ酸メチル HCOOCH3 である。尚、ギ酸メチルと酢酸は構造異性の関係にある。次のzomeによる分子模型(ここでは非共有電子対も全て示している)は、酢酸とメタノールの脱水縮合で得られる酢酸メチル CH3COOCH3 というエステルである。カルボニル基の炭素原子は sp2 混成状態にあり、価電子は3つのsp2軌道(青ストラット)とこの3つのsp2と直交する2p軌道(上下の黄色ストラット1組)のそれぞれに1つずつ入っている。酸素原子(赤ノード)は2つあるが、カルボニル基を形成する酸素原子もsp2 混成状態にあり、6つの価電子の状態は (sp2)2(sp2)2(sp2)1(2p)1であり、炭素原子とは sp2軌道どうしでσ結合を、2p軌道どうしでπ結合を形成している。これらが C=O 二重結合である。メチル基と結合している酸素原子も sp2 混成状態にあり、6つの価電子の状態は (sp2)2(sp2)1(sp2)1(2p)2 となっていて、この酸素原子は sp2軌道により2つの炭素原子とσ結合を形成している。こちらの酸素原子の場合は、上下の黄ストラット1組で示される2p軌道には電子2個が入っているので、炭素原子とはπ結合しなくとも良い訳であるが、実際は軌道が重なれるので、2p電子は非局在化している。
尚、酢酸メチルは、プロピオン酸(プロパン酸) CH3CH2COOH とは構造異性の関係にある。
 フェノール類
フェノール類
ベンゼン環に直接ヒドロキシ基(-OH)がついた化合物を総称してフェノール類という。最も簡単なものはフェノール C6H5OH である。フェノール類もアルコール同様炭素原子にヒドロキシ基がついた化合物であるが、アルコールは中性であるのに対して、フェノール類は弱酸性を示すことが大きな違いである。
下の左図はzomeで作成したフェノール分子の模型である。ベンゼン環では各6個の炭素原子(sp2混成状態)が、sp2軌道どうしでσ結合を6個形成して平面リングを作っている。また、6個の炭素原子にある2p軌道(上下1組の黄ストラットで示され、この軌道に電子が1個ずつある)どうしでπ結合をしている。このπ結合は環全体に広がっていて、6個の電子は6個の炭素原子全体に広がったπ結合の軌道に非局在化して存在している。この炭素原子の1つに酸素原子(赤ノード)がつながっている。酸素原子の原子価は6であり、酸素原子の原子価電子の状態は、(sp2)2(sp2)1(sp2)1(2p)2 となっていて、酸素原子の不対電子が入った1つのsp2軌道と炭素原子のsp2軌道とでσ結合(C-O)を形成している(青ストラットで示した)。もう一つの不対電子が入ったsp2軌道は水素原子の1s軌道とでσ結合(O-H)を形成している(青ストラットで示した)。電子が2個入っているsp2軌道(ノードとつながっていない青ストラットで示した)と2p軌道(上下1組の黄ストラット)があるが、これは軌道が満たされているので、酸素原子には2組の非共有電子対が残るということになる。
 |  |
| フェノール | フェノキシドイオン |
フェノールから水素原子(O-HのH)がH+として外れてできるのがフェノキシドイオン C6H5O- である。フェノキシドイオンのzome模型が上の右図である。フェノール分子を見て分かるように、酸素原子上の黄ストラットで示された2p軌道は、ベンゼン環のπ結合を形成している軌道と重なることができる。よって、フェノールからH+が外れると、その瞬間は酸素原子上に負電荷が局在化して残るが、しかしこの負電荷(つまりは電子)は、ベンゼン環のπ軌道にも非局在化できるので、フェノキシドイオンはある程度安定になる。従って、フェノールはH+を放すことができる、つまりは、酸として働くことができるのである。
尚、これに対してアルコール R-OH では、プロトン(H+) が外れた後にできる アルコキシドイオン R-O- の酸素上に残る負電荷が酸素原子に局在化するだけなので、フェノキシドイオンほど安定にならないので、アルコールはフェノールよりもずっと酸性が弱く、普通は酸としては働かないのである。
 芳香族アミン
芳香族アミン
炭化水素基(-R)にアミノ基(-NH2)が結合してできたものを、一般にアミンといい、R-NH2 で示される。アミノ基はアンモニアから水素原子が外れて出来た基であるから、アミノ基を持つアミンもアンモニアと同様に弱塩基性を示す。
メチルアミン CH3NH2 をzomeで作成したものが次の図である。ここでは窒素原子(青ノード)はsp2混成状態にあるとした。窒素原子の価電子は5であるので、3つのsp2軌道に電子が1個ずつ入り、残り2つの電子は2p軌道(上下1組の黄ストラット)に入りこれを満たすことになる(これが非共有電子対)。そして、sp2軌道が炭素原子及び水素原子2つとσ結合(青ストラット)をしてメチルアミン CH3NH2ができる。ところで、メチルアミンはアンモニアよりも若干塩基性が強くなるのであるが、それはメチルアミンの方がアンモニアよりも窒素原子上の電子の密度が若干大きくなる為である。これは、メチルアミンの場合、窒素原子につながっているメチル基(-CH3)の3つのC-H結合(黄ストラット)の内の1つが丁度窒素原子の非供給電子対のある2p軌道と重なり、窒素原子の方が炭素原子よりも電気陰性度(結合電子を引き付ける能力)が大きいので、C-H結合電子が窒素原子の方に若干移る(超共役)ので、電子の密度が若干大きくなる為と説明される。
アミンの中で炭化水素基が芳香族性のものを芳香族アミンといい、その中で最も簡単な化合物がアニリン C6H5NH2 である。次は、アニリンのzome分子模型である。アニリンはアンモニアよりも塩基性が弱い。それは、アニリンの窒素原子(青ノード)上の非共有電子対(上下1組の黄ストラットが非共有電子対1組が入る軌道)の密度が若干小さくなる為である。この模型からも分かるように、アニリンの窒素原子の2p軌道はベンゼン環のπ結合の軌道と重なることができ、この場合はベンゼン環のπ軌道の方に電子が引かれるので、窒素原子の2p軌道電子の密度が若干低下することになる。



 アルカン
アルカン





 アルケン
アルケン


 アルキン
アルキン
 シクロアルカン
シクロアルカン

 共役ジエン
共役ジエン

 芳香族炭化水素
芳香族炭化水素
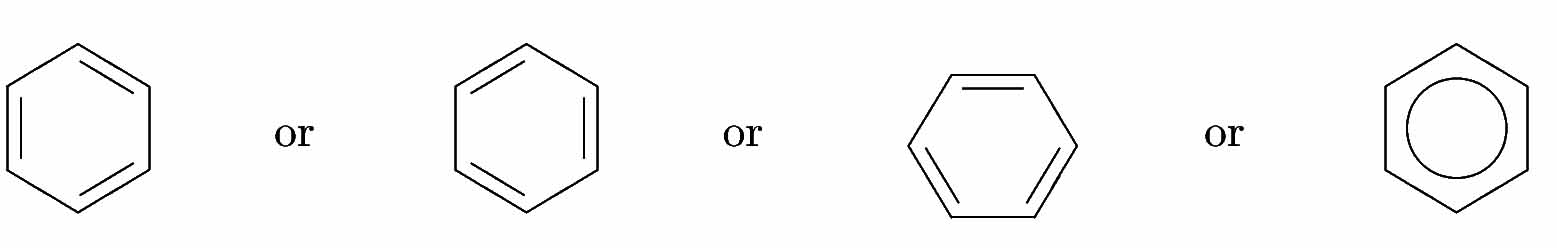

 アルコールとエーテル
アルコールとエーテル


 カルボン酸
カルボン酸

 アルデヒドとケトン
アルデヒドとケトン

 (カルボン酸)エステル
(カルボン酸)エステル
 フェノール類
フェノール類

 芳香族アミン
芳香族アミン