分子・イオン

 水分子
水分子
水の分式は H2O であり、構造式で記すと H-O-H であるが、分子の形は一直線ではなくV字形をしている。zomeで水分子を構築すると、次のようになる。赤ノードが酸素原子、白ノードが水素原子であり、O-H単結合は黄ストラットで示される。
何故、水分子がV字形の分子になるかは、水分子を点電子式で示すことで理解できる。次が水分子の点電子式である。
水分子の酸素原子には水素原子と共有される電子対(共有電子対)が2組あり、これらがO-H単結合(σ結合)である。しかし、酸素原子上には水素原子とは共有されない電子対(非共有電子対)が2組残る。非共有電子対は水素原子と結びついていないが、共有電子対と同様に3次元の空間に存在する。これら4つの電子対がお互いに最も離れたところにあるのが安定である。つまり、4つの電子対は酸素原子を中心として正四面体の頂点方向を向くことになる(実際は、共有電子対と非共有電子対では電子の広がりが異なるので、正確に正四面体の頂点方向には向かない)。
zomeで、次のように4つの電子対を黄ストラットで示すと、このことがはっきりする。
尚、水分子がV字形を示すことを、混成軌道理論を用いて、酸素原子の4つのsp3混成軌道(これらは正四面体の頂点方向を向く)の内2つが電子で満たされ、残り2つが水素原子の1s軌道と重なってσ結合(単結合)を形成すると考えても良い。
 アンモニア分子
アンモニア分子
アンモニアの分式は NH3 であり、分子の形は三角錐である。zomeでアンモニア分子を構築すると、次のようになる。青ノードが窒素原子、白ノードが水素原子であり、N-H単結合は黄ストラットで示される。
何故、アンモニア分子が三角錐の分子になるかは、アンモニア分子を点電子式で示すことで理解できる。次がアンモニア分子の点電子式である。
アンモニア分子の窒素原子には水素原子と共有される電子対(共有電子対)が3組あり、これらがN-H単結合(σ結合)である。しかし、窒素原子上には水素原子とは共有されない電子対(非共有電子対)が1組残る。非共有電子対は水素原子と結びついていないが、共有電子対と同様に3次元の空間に存在する。これら4つの電子対がお互いに最も離れたところにあるのが安定である。つまり、4つの電子対は窒素原子を中心として正四面体の頂点方向を向くことになる(実際は、共有電子対と非共有電子対では電子の広がりが異なるので、正確に正四面体の頂点方向には向かない)。
zomeで、次のように4つの電子対を黄ストラットで示すと、このことがはっきりする。
尚、アンモニア分子には結合に関与していない非共有電子対が1組あるので、空の軌道を持つH+ に電子対を提供できる(アンモニアが塩基性を示すのはこの為である)。こうしてできるのがアンモニウムイオン NH4+であり、次のzomeで作った分子模型の通りアンモニウムイオンは正四面体形をしている。
 オゾン分子
オゾン分子
酸素O2の同素体であるオゾンの分子式はO3であり、酸素原子の原子価(平たく言えば結合の手の数)は2であるから(だから酸素分子の構造式はO=Oとなると一応説明される)、オゾン分子は正三角形をしていると誤解されがちである。しかし、実際のオゾン分子の形は二等辺三角形である。
オゾン分子は1つの構造式で書くことはできない。オゾン分子の構造式は O-O=O 或いは O=O-O である。構造式で書くとオゾンは、酸素原子の原子価=2 を全く満たしていないのが、電子式では
と書くことができ、実際のオゾン分子はこの2つの平均的な構造を持つと一応理解される。従って、オゾンは環状構造を持つ正三角形の分子ではない。それから中央の酸素原子上には非共有電子対が残り、これが3次元の空間の一定方向を占有するから、オゾン分子は折れ曲がり、従って、二等辺三角形になる。
zomeでオゾン分子を次のように構築すると、分子の形も結合もよりはっきりする。
つまり、3つの酸素原子はいずれもsp2混成状態にあり、両端の酸素原子はsp2混成軌道の2つは電子で満たされ(これらの非共有電子対は省略されている)、1つのsp2混成軌道がそれぞれ中央の酸素原子のsp2混成軌道とσ結合する。このσ結合は青ストラットで示されている。酸素の価電子数は6であるから、残り1個の電子は3つのsp2混成軌道が作る平面に直交するp軌道に残ることになる。このp軌道が黄ストラットで示されている。中央の酸素原子にある2つのsp2混成軌道は両端の酸素原子のsp2混成軌道とσ結合を作ることになり、残りの1つのsp2混成軌道には電子が2つ入り(この非共有電子対は上のzomeによる分子模型では省略されている)、p軌道には電子が2個入る。そして、3つの酸素原子のp軌道どうしでπ結合をし、このπ軌道に合計4個の電子が入っているというのがオゾン分子である。π電子の非局在化によりオゾン分子はある程度安定になる。
オゾン分子を非共有電子対まで含めてzomeで構築したものが
である。ここでは、全てのsp2混成軌道は青ストラットで示されていて、ノード間にある青ストラットはσ結合を意味しているが、それを含めて全ての青ストラットには共有or非共有電子が2個ずつ入っている。p軌道は黄ストラットで示されているが、酸素原子の価電子数は6であるから、両端のO原子のp軌道には電子が1個ずつ、中央の酸素原子のp軌道には電子が2個入っていることになり、これら3つのp軌道でπ結合を形成するのである。
 二酸化炭素
二酸化炭素
二酸化炭素 CO2 の構造式は、炭素原子の原子価(結合の手の数)が4で、酸素原子の原子価は2であるから、O=C=O であり、中心の炭素原子には非共有電子対がないので、分子の形は直線となる。というところまでは簡単であるが、どういう結合をしているかということについて少しだけ厳密な話をすると、やや難しくなる。混成軌道理論で話を進めると、分子中の炭素原子は sp混成状態にあり、2つのsp混成軌道と、これに直交する2方向(sp混成軌道の方向をx方向とすると、y方向とz方向)にp軌道があり、これらの軌道に1つずつ電子が入った状態が炭素原子である(ノードにつながっていない青ストラット1組がそれぞれp軌道を示す)。両端の酸素原子はsp2混成状態にあり、3つのsp2軌道のうち2つに電子が2つ入り(非共有電子対で満たされているsp2軌道はzome模型ではノードにつながっていない緑ストラットで示されている)、残り1つのsp2軌道には電子が1個入った状態にあり、更にこれら3つのsp2軌道が作る平面に直交する方向を向くp軌道に電子が1個入った状態にある(酸素の6個の価電子がこのように配置される)。炭素原子の2つのsp軌道が両端の酸素原子のsp2軌道と重なってσ結合を形成する。次のzomeの模型では、σ結合は青ストラットで示される。そして、C=O二重結合のもう一つの結合は、炭素原子のp軌道と酸素原子のp軌道でできるπ結合である。2つのπ結合の方向は90°ずれていることに注意していただきたい。zomeの模型で分かるように、酸素原子の非共有電子対が入っている2つの軌道(緑ストラット)が作る平面は、右側の酸素原子と左側の酸素原子で90°ずれることになるのである。尚、黒ノードが炭素原子で、赤ノードが酸素原子である。
 一酸化炭素
一酸化炭素
では、一酸化炭素は、2原子分子なので直線分子であるのは明らかであるが、どのような結合をしているのだろうか。炭素の原子価(結合の手の数)が4、酸素の原子価は2であるから、構造式で一酸化炭素を表すのは簡単ではない。炭素原子は原子価が4であり、2s軌道に2個、2つの2p軌道に1個ずつで2個入った状態が基底状態(最もエネルギーの低い状態)である。これを記述すると、(2s)2(2px)1(2py)1 となる。酸素原子は原子価が6であるから、基底状態を記述すると (2s)2(2px)2(2py)1(2pz)1 となる。ここで、酸素から電子が1個炭素原子に移ると考えると、C- (2s)2(2px)1(2py)1(2pz)1 及び O+ (2s)2(2px)1(2py)1(2pz)1 となり、結合軸を x 方向とすると、両原子の 2px 軌道の重なりでσ結合ができ、それと直交する2py及び2pz軌道どうしで2つのπ結合ができる。従って、CO分子を構造式で記述すると、-C≡O+ となる。一酸化炭素は三重結合でできているのでなかなか安定である。だから、酸素と共存しても常温では二酸化炭素にはならない。また、結合電子を引き寄せる能力(電気陰性度)は酸素原子の方が炭素原子よりも大きいので、-C≡O+ の電荷の偏りはかなり小さくなる。
一酸化炭素分子をzomeで作ると、次の左の図のようになる。ノードからある方向とそれと逆方向につながっている1組の青ストラットが1つのp軌道を示している。結合方向でp軌道どうしが重なってできるのがσ結合という強い結合で、σ結合は黒ノードと赤ノードの間の青ストラットがそれである(結合の逆方向にある青ストラットは無くしても良いのかも知れない)。それから、このσ結合に直交する2つの向きで、p軌道どうしが重なる。この重なりによる結合(π結合)は結合の方向と直交するのでσ結合よりは弱い結合である。この場合、π結合は2つできる。残念ながらzomeそのものではπ結合は表現できないので、頭の中に描くしかない。因みに、C- 及び O+ の電子の状態は、窒素原子の基底状態と同じであるから、窒素分子 N2 (構造式では N≡N ) もCO分子と同じ三重結合(σ結合が1つとπ結合2つ)をする。右側が窒素分子である。zome模型では窒素原子は青ノードで示している。
 過酸化水素
過酸化水素
過酸化水素 H2O2 を構造式で記述すると、酸素と水素の原子価(結合の手の数)は2及び1であるから、H-O-O-H となる。酸素原子には非共有電子対があり、これらが3次元の空間の一定方向を占めるので、過酸化水素分子の形は一直線にはならず、平面で示せば
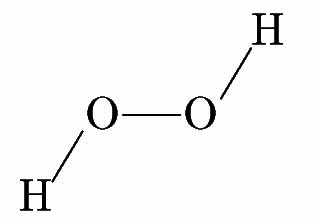
となる。しかし、4つの原子は、電子対どうしの反発により、同一平面上にはないものが安定であり、2つのOH結合はねじれている。過酸化水素分子をzomeで作成すると、次のようになり(ねじれの角度は正確なものにはならない)、これを見れば過酸化水素分子の大凡の形が分かる。このzomeの模型では、酸素原子の非共電子対は一端がノードにつながっていない黄ストラットで示されている。両端がノードにつながっている黄ストラットはσ結合(単結合)を表し、ここに共有電子対があるということになる。
 硝酸
硝酸
硝酸 HNO3 では、窒素原子の原子価は5である。アンモニアでの窒素原子の原子価は3であるが、これはアンモニアの窒素原子では5個の最外殻電子の内のp軌道の3個の電子が結合に関与しているということを意味する。これに対して、硝酸に於ける窒素原子では全ての最外殻電子が結合に関与するということを意味する。硝酸を構造式で記述すると
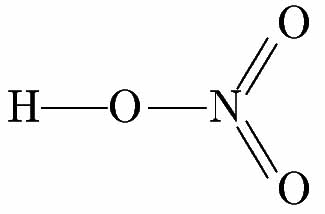
となる。中心にある窒素原子(sp2混成状態)の価電子の状態は、(sp2)1(sp2)1(sp2)1(2pz)2 となっている。そして、3つのsp2軌道がそれぞれ3つの酸素のp軌道と重なり結合性の軌道を作り電子対を共有することになる。これがσ結合である。次のzomeの模型(左側が硝酸分子)では赤ノード(酸素原子)と青ノード(窒素原子)を結ぶ青ストラットがこのσ結合を示している。水素原子と結合していない酸素原子は、非共有電子対2組(zome模型では省略されている)と2pz軌道(黄ストラットで示されている)に電子が1個入っている。そして、窒素の2pz軌道(黄ストラットで示されている)とそれぞれπ結合を形成する。これがN=O二重結合の部分である。水素原子とσ結合している酸素原子の2pz軌道は電子で満たされているので、この酸素原子と中心の窒素原子とがπ結合することはないので、両者の間は単結合になる。
尚、上の右図は硝酸イオン NO3- のzome模型であるが、硝酸からプロトン(H+)が1つ外れると、中心の窒素原子の2pzと3つの酸素原子の2pzが重なって、非局在化されたπ結合ができる(3個のπ結合に5個の電子が非局在化する)。これにより NO3- は非常に安定化するため、硝酸は強酸なのである。
 亜硝酸
亜硝酸
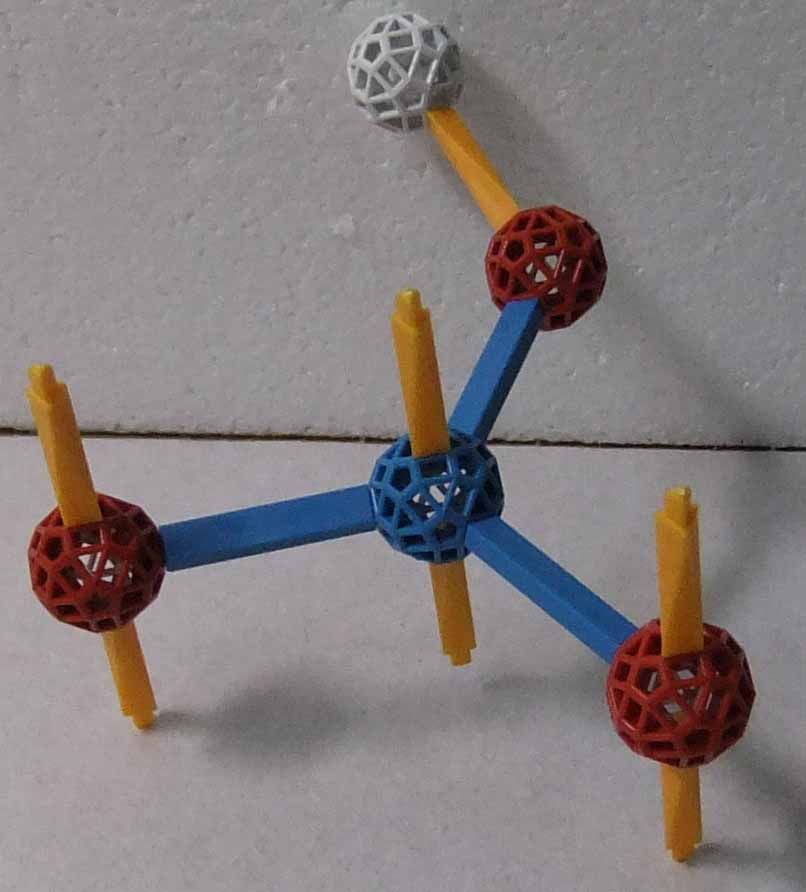
亜硝酸 HNO2 は、不安定な酸で非常に希薄な水溶液中に存在できる物質である。ただし、亜硝酸塩は常温での存在する。亜硝酸中の窒素原子の原子価を3であるとすると、その構造式は H-O-N=O と記述できるが、窒素原子には非共有電子対があるので、直線分子ではない。次の2つは亜硝酸分子をzomeで作ったものである。窒素原子はsp2混成状態にあり、価電子の電子配置は (sp2)2(sp2)1(sp2)1(2pz)1 である。2つの非共有電子対で満たされるsp2混成軌道は、一端がノードにつながっていない青ストラットで示される。電子が1つずつ入っているsp2混成軌道は酸素原子のp軌道と重なりσ結合を形成する。これが青ノード(窒素原子)と赤ノード(酸素原子)間の青ストラットである。そして、水素原子がつながっていない方の酸素原子の2pz軌道(黄ストラット)と窒素原子の2pz軌道(黄ストラット)でπ結合をして、亜硝酸分子ができている。尚、亜硝酸分子には N-O についてcis体(左図のもの)とtrans体(右図のもの)の2つがあり、平衡状態にある。因みに、trans体の方が安定である。いずれの場合も酸素原子の非共有電子対は省略した。
 |  |
| cis体 | trans体 |
尚、亜硝酸が不安定で、亜硝酸イオンになると安定になるのは、zomeで作成した次の亜硝酸イオンを見ても分かるように、窒素原子が2つの酸素原子とπ結合をして、このπ結合に存在する4つのπ電子が非局在化する為である。この模型でも酸素原子の非共有電子対は省略した。
 黄リン
黄リン
リンにはいくつかの同素体があるがその1つが黄リンである。黄リンは本来は白リンと呼ぶべきであるが、その表面に薄い赤リンの被膜ができるので黄リンと呼ぶ。白リンはP4の正四面体分子であり、zomeでその模型を作ると次のようになる。ここで、リン原子は緑ノード、P-P結合は緑ストラットで示している。
では、どうしてリン原子は4個つながって正四面体分子を形成するかを考えてみたい。リン原子の原子価は、窒素原子と同じで 3 or 5 である。分子模型を見るとリン原子の原子価(結合の手の数)は3で、これにより単結合してできていると考えたいが実は少し違う。リン原子の最外殻の電子配置は (sp3)2(sp3)1(sp3)1(sp3)1 で、sp3軌道どうしが重なって P-P 結合を作り、各リン原子には非共有電子対で満たされたsp3が残る(上のzome模型では、非共有電子対は省略されている)。
 十酸化四リン
十酸化四リン
リンの酸化物でリン原子が最高酸化数をとっているのが十酸化四リンで、酸化リン(V)ともいい、その分子式は P4O10 である。組成式が P2O5 であるので、以前は(というか古くは)五酸化二リンとも呼んだ。十酸化四リン分子をzomeで構築すると、次のようになる。今度は、P-O 結合は黄ストラットで示している。
十酸化四リン分子ではリン原子を結ぶと丁度白リンのように正四面体を形成することが分かる。十酸化四リンでは、白リンのリン原子間(直線上という意味ではない)に酸素原子が入り、更にそれぞれのリン原子は単独で酸素原子と結合している構造を持っている。尚、P-O-P のP-O結合は単結合であるが、リン原子と単独で結合する酸素原子との結合は P=O 二重結合である(これでリン原子の原子価は5となっている)。
因みに、リン原子も酸素原子も全て炭素原子で置き換えると、これはダイヤモンドの一部と同じになる。
 オルトリン酸
オルトリン酸
十酸化四リンは吸湿性が大きく、水に溶かすと加水分解を受けて種々なオキソ酸が生成する。これらのオキソ酸の総称がリン酸である。その中で、分子式が H3PO4 で示されるものがオルトリン酸である。尚、普通、リン酸と言えば、このオルトリン酸を指す。オルトリン酸の分子模型をzomeで作ると次のようになる。
オルトリン酸分子と十酸化四リン分子を比べると分かると思うが、十酸化四リン分子の模型の上のPO4の正四面体部分を外し、結合を外された下の3つの酸素原子に水素原子(白ノード)を取り付けるとオルトリン酸分子になる。オルトリン酸分子では、3つの H-O-P 結合は全て単結合であり、水素原子と結合していない酸素原子とリン原子の間は P=O 二重結合となっている(これでリンの原子価は5であることになる)。
 三酸化硫黄
三酸化硫黄
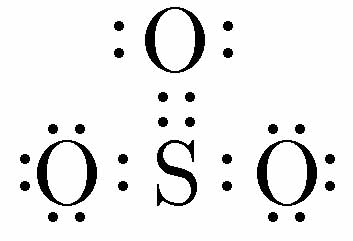
三酸化硫黄 SO3 は、硫黄の酸化数が +6 と最高になっている硫黄酸化物である。硫黄原子の原子価を6とすると、構造式は次の左図のように示すことができる。SとOはどれもS=O二重結合になれば硫黄原子の原子価=6を満たす。ただし、三酸化硫黄分子を電子式で、オクテット則を満たすように記述すると、右図のようになり、構造式と電子式の間で整合性がとれなくなる。
観測される三酸化硫黄分子は気体として存在するときは、次のzomeによる分子模型のように平面三角形をとっている。中心の硫黄原子に非共有電子対がないので、3つの酸素原子はそれぞれ最も離れた方向を向く為である。黄ノードが硫黄原子であり、青ストラットは硫黄原子と酸素原子間のσ結合で、黄色ストラットはp電子をしめしていて、S原子とO原子間で3つのπ結合を形成し、ここに6個のπ電子(p電子)があることになる。ただし、このzome模型では酸素原子にある非共有電子対(軌道)はいずれも省略されている。
尚、三酸化硫黄の気体が凝集すると、γ-SO3 と呼ばれる三量体が形成される。
 硫酸・硫酸イオン・チオ硫酸イオン
硫酸・硫酸イオン・チオ硫酸イオン
三酸化硫黄 SO3 と水が反応すると、硫酸 H2SO4 ができる。硫酸の構造式は
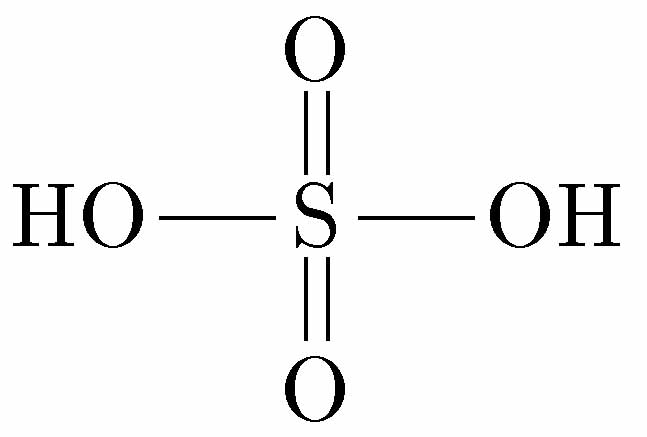
で示され、硫黄の原子価は三酸化硫黄と同じで6である。硫酸分子のzome模型が下の左の図である。H-O-Sの2つの結合はいずれも単結合であり、残りの2つの結合は S=O 二重結合となっているが、全て黄ストラットで示している。硫黄原子を中心とした正四面体の4つの頂点に酸素原子は位置していることが分かるであろう。硫酸 H2SO4 からプロトン(H+)が2つ外れてできるのが硫酸イオン SO42- であり、そのzome模型が下の中央の図である。硫酸イオンは正四面体形である。硫酸イオンでは、4つのS-O結合は全て均等であり、電荷 2- は4つの酸素原子に非局在化して存在している。従って、硫酸イオンは非常に安定になる。硫酸が強酸であるのは、これによる。硫酸イオンの1つの酸素原子が硫黄原子で置き換わったものが、チオ硫酸イオン S2O32- である。 物質としては、チオ硫酸ナトリウム Na2S2O3 として存在する。下の右図がチオ硫酸イオンのzome模型である。硫黄は酸素の同族であるので、酸素原子の代わりに硫黄原子が入ったものもできるのである。



 水分子
水分子


 アンモニア分子
アンモニア分子



 オゾン分子
オゾン分子


 二酸化炭素
二酸化炭素
 一酸化炭素
一酸化炭素

 過酸化水素
過酸化水素

 硝酸
硝酸

 亜硝酸
亜硝酸


 黄リン
黄リン
 十酸化四リン
十酸化四リン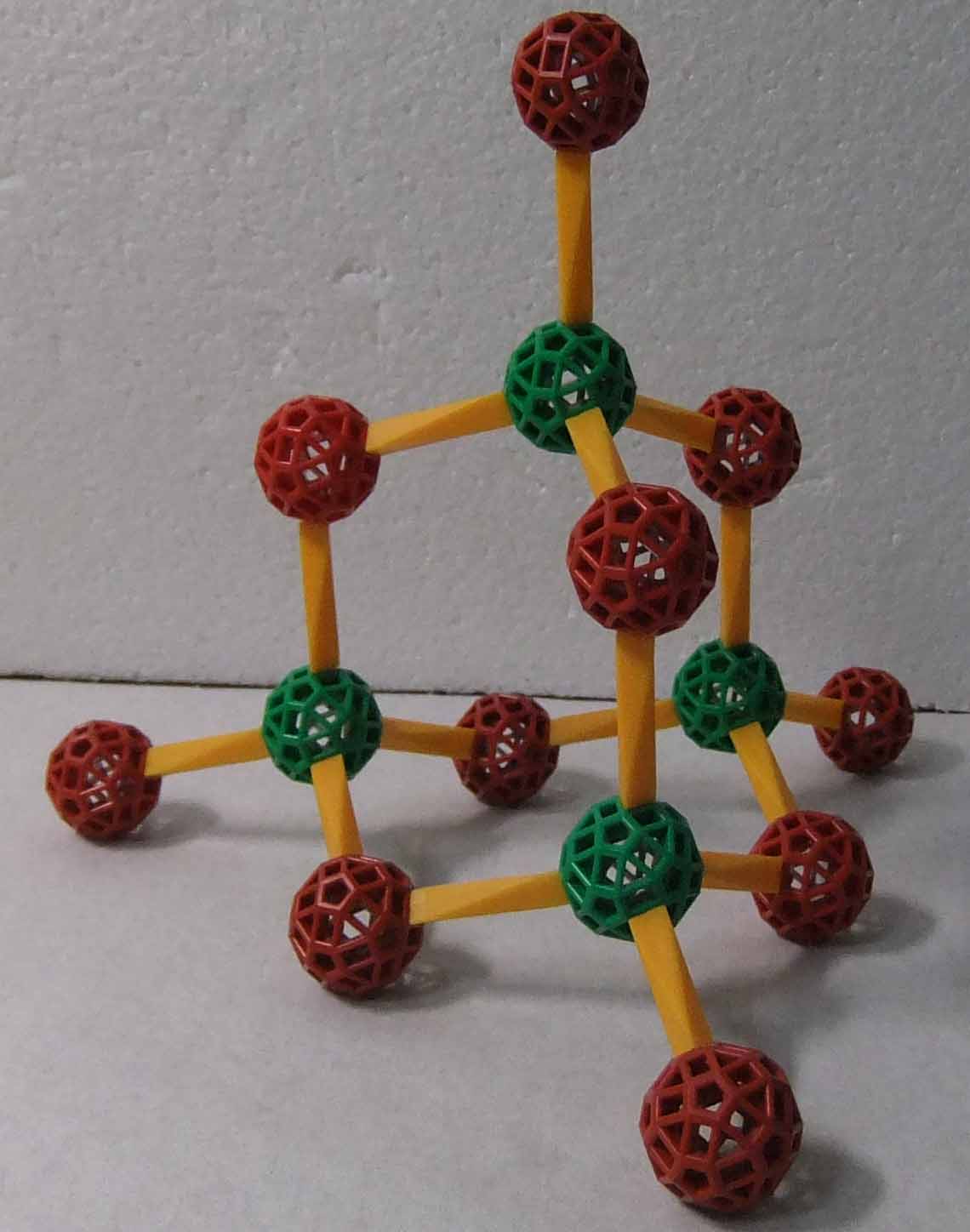
 オルトリン酸
オルトリン酸
 三酸化硫黄
三酸化硫黄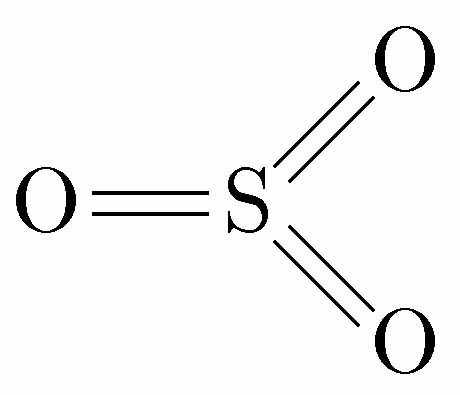


 硫酸・硫酸イオン・チオ硫酸イオン
硫酸・硫酸イオン・チオ硫酸イオン



